新藥商業化在即 康方生物宜低吸 券商最牛上望80元 潛在升幅逾7成!
撰文:經一編輯部| 圖片:iStock、Unsplash
授權自研生物藥物予五大藥企
成立於2012年的康方生物,當年是中山市引進的十大重點項目之一,為研究、開發、生產及商業化創新抗體新藥的生物製藥企業,尤其專注腫瘤及免疫治療領域。
2015年,集團將腫瘤免疫療法藥物AK107授權予德國默克(Merck),成為了首間將自研發生物藥物授權予國際五大製藥企業的內地公司。
康方現時的藥物開發平台和體系,已涵蓋藥物發現和開發功能,包括靶點驗證、抗體發現與開發、CMC生產工藝開發和符合GMP標準的規模化生產,並已成功開發雙特異抗體藥物開發技術。
目前產品管線擁有20款以上用於治療腫瘤、自身免疫、炎症、代謝疾病等重大疾病的創新藥物,其中九個品種已進入臨床研究,包括兩個國際首創的雙特異性抗體新藥。
開展多項臨床試驗
集團早年與中國生物製藥(01177)旗下正大天晴組成的合營公司,共同開發及商業化創新藥派安普利單抗(PD-1)。
該藥可用於單一療法或聯合療法,布局的主要適應症包括肝癌、胃癌及肺癌等疾病,並已開展多項派安普利聯合安羅替尼在多個瘤種的臨床試驗。
近期派安普利的研發取得重大進展。有關新藥聯合紫杉醇和卡鉑用於局部晚期或轉移性鱗狀非小細胞肺癌一線治療的三期臨床試驗中期分析,於2月底達到主要研究終點。
已計劃遞交相關新適應症上市申請,並正與國家藥品監督管理局藥品審核中心進行溝通。
另外,派安普利聯合安羅替尼一線治療晚期肝癌的最新研究,剛於2021年國際胃腸道癌症研討會上發布。安全性及抗腫瘤活性數據均理想,相關第三期臨床試驗正在進行中。
自研新藥獲美國孤兒藥資格
而派安普利用於治療霍奇金淋巴瘤的新藥上市申請,已經獲得國家藥品監督管理局受理,未來發展值得期待。
至於集團核心自主研發的新型腫瘤免疫治療雙特異性抗體新藥Cadonilimab(研發代號AK104),於今年2月中,獲得美國食品及藥物監管理局(FDA)授予的孤兒藥資格認定,用於治療宮頸癌。
根據1983年訂立的《孤兒藥法案》,凡獲得孤兒藥資格的候選藥物,有機會獲得七年市場獨佔權,以及FDA提供的稅收減免、生物製品許可證申報費減免等一系列配套支持。
2020年4月康方來港上市,市場反應熱烈,公開發售部分錄得638倍超額認購,以招股範圍上限16.18元定價,籌得淨額24.37億元,當中七成半用於產品研發及商業化。
今年1月,集團進一步加強資本,按每股作價39.6元,配售3,000萬股新股,集資淨額11.71億元。
集資主要用於設立商業化團隊,以籌備明年推出AK104;同時在廣州及中山翠亨新區興建新生產設施,以增加產能配合未來發展。
另外,國家醫保局第四批全國藥品集中採購將於今年5月執行,藥物範疇涉及高血壓、糖尿病、消化道疾病、精神類疾病、惡性腫瘤等多種治療領域。
大行睇好 給予買入或增持評級
交銀國際指出,生物類似藥及大品種中成藥未來亦將納入集中採購名單,故有利創新型生物科技企業,尤其看好康方的AK104藥物前景,皆因其療效及安全性已取得驗證優勢,有望進一步拓展海外市場。
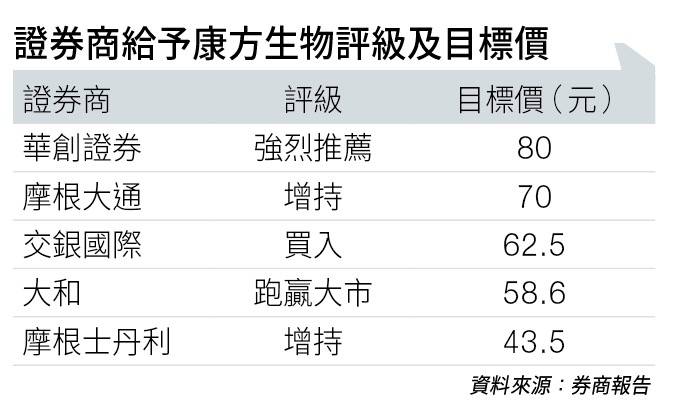
故此將目標價由45.89元,調高至62.5元,並給予「買入」投資評級(見圖表)。
大和認同,雙抗新藥AK104配合化療的治療效果良好,並即將在內地商業化,現階段已開始物色合作夥伴拓展海外市場。
華創證券最牛目標價80元
華創證券則強烈推薦,給予目標價80元,該行認為康方成功實現差異化布局,新藥AK104有望明年提交上市申請。
此外,與中國生物製藥共同開發的創新藥AK105,預計明年將獲批;借助正大天晴強大的銷售能力,將可搶佔可觀市場份額。
該行相信,未來幾年康方將由研發型生物科技企業,轉型為生物製藥平台。預測2020年至2022年主營業務收入分別3,700萬、4.9億及14.68億元人民幣;料明年有望轉虧為盈。本週五(3月12日),康方生物股價收報44元。
免責聲明:本專頁刊載的所有投資分析技巧,只可作參考用途。市場瞬息萬變,讀者在作出投資決定前理應審慎,並主動掌握市場最新狀況。若不幸招致任何損失,概與本刊及相關作者無關。而本集團旗下網站或社交平台的網誌內容及觀點,僅屬筆者個人意見,與新傳媒立場無關。本集團旗下網站對因上述人士張貼之資訊內容所帶來之損失或損害概不負責。